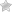Основными легирующими элементами магниевых сплавов являются Mn, Al, Zn (Рис.3.1). Для дополнительного легирования используют цирконий, кадмий, церий, неодим и др.
а б в
Рис. 3.1. Диаграмма состояния и механические свойства сплавов: a – Mg-Mn , б – Mg- Al, в – Mg-Zn и механические свойства сплавов
Рис. 3.2. Влияние легирующих элементов на механические свойства магния при 20°C (прессованные прутки)
Рис. 3.3. Влияние легирующих элементов на твердость магния при 250°C.
Марганецс магнием образует твердый раствор a. При понижении температуры растворимость марганца в магнии понижается и из a-твердого раствора выделяется b-фаза (рис.3.1,а). Марганец не улучшая механические свойства, повышает сопротивление коррозии и свариваемость сплавов магния.
Алюминий и цинк в количестве до 6-7%, образующие с магнием твердые растворы и соединения Mg4Al3 и MgZn2 , повышают механические свойства магния (рис. 3.2.1,б и в).
Механические свойства сплавов магния при комнатной температуре улучшаются при легировании цирконием, при повышенной температуре – добавкой церия, неодима, особенно тория (рис.3.2.3).
Цирконий и торий оказывают модифицирующее действие на структуру сплавов магния. Особенно эффективно модифицирует цирконий. Добавка 0,5-0,7% Zr уменьшает размер зерна в 80-100 раз. Это объясняется структурным и размерным соответствием кристаллических решеток Mg и Zr .
Кроме того, цирконий и марганец способствуют устранению или значительному уменьшению влияния примесей железа и никеля на свойства сплавов.
Они образуют с этими элементами промежуточные фазы большой плотности, которые при кристаллизации выпадают на дно тигля, очищая тем самым сплавы от вредных примесей.
Прочностные характеристики магниевых сплавов существенно повышаются при термомеханической обработке, состоящей в пластической деформации закаленного сплава перед его старением.
Магниевые сплавы обладают высокой пластичностью в горячем состоянии и хорошо деформируются при нагреве. Для деформированных сплавов диффузионный отжиг обычно совмещают с нагревом для обработки давлением.
Магниевые сплавы хорошо обрабатываются резанием, легко шлифуются и полируются. Они удовлетворительно свариваются контактной роликовой и дуговой сваркой, которую рекомендуется проводить в защитной атмосфере.
Недостатками магниевых сплавов являются плохие литейные свойства и склонность к газонасыщению, окислению и воспламенению при литье. Для предотвращения дефектов при выплавке используют специальные флюсы, для уменьшения пористости применяют небольшие добавки кальция (0,2 %), а для снижения окисляемости — добавки бериллия (0,02-0,05 %).
3.3. Термическая и термомеханическая обработка магниевых сплавов
Термическая обработка магниевых и алюминиевых сплавов имеет много общего. Это объясняется близкими температурами плавления и отсутствием полиморфных превращений.
Увеличение растворимости легирующих элементов в магнии с повышением температуры (рис. 3.3.1) дает возможность упрочнять магниевые сплавы с помощью закалки и искусственного старения.
Рис. 3.4. Растворимость легирующих элементов в магнии
Особенностью магниевых сплавов является пониженная скорость диффузии большинства компонентов в магниевом твердом растворе. Низкие скорости диффузионных процессов способствуют развитию дендритной ликвации, требуют больших выдержек при нагреве, облегчают фиксацию твердых растворов при закалке и затрудняют распад пересыщенных растворов при старении.
Для снижения уровня ликвации и повышения технологической пластичности перед деформацией слитки подвергают гомогенизирующему отжигу. Деформированные полуфабрикаты из магниевых сплавов отжигают для снятия остаточных напряжений.
Для повышения прочностных свойств магниевые сплавы подвергают закалке и старению. Из-за низкой скорости диффузии закалку обычно проводят на воздухе, применяют искусственное старение при сравнительно высоких температурах (до 200- 250 °С) и более длительных выдержках (16-24 ч).
При использовании магниевых сплавов в качестве жаропрочных температура старения во избежание коагуляции упрочняющих фаз должна быть выше рабочей температуры.
Термическая обработка магниевых сплавов затруднена из-за замедленных диффузионных процессов в твердом растворе магниевых сплавах.
Малая скорость диффузии требует больших выдержек при нагреве под закалку (до 16-30 ч.) для растворения вторичных фаз (Рис.3.5). Благодаря тому такие сплавы можно закаливать на воздухе, они не склонны к естественному старению. При искусственном старении необходимы высокие температуры (до 200 °С) и большие выдержки (16-24 ч.).
Многие сплавы закаливают при охлаждении изделий после горячей обработки давлением на воздухе, а, следовательно, они могут упрочняться при искусственном старении без предварительной закалки. Гомогенизацию и закалку осуществляют при нагреве до 380-540°С (Т4) и последующее старение при 150-200°С (Т6).
Рис.3.5. Микроструктура сплава МЛ5 , х250:
а– в литом состоянии (α-твердый раствор + включения Mg4Al8) ; б – в закаленном состоянии (перенасыщенный α-твердый раствор)
Наибольшее упрочнение термической обработкой достигается у сплавов магния, легированных неодимом.
В этом случае при распаде пересыщенного твердого раствора в зависимости от температуры и времени старения могут образоваться зоны Гинье- Престона, метастабильные и стабильные упрочняющие фазы, тогда как в некоторых сплавах ( например, сплавах системы Mg-Al-Zn) при старении сразу появляются стабильные фазы.
- Временное сопротивление и особенно предел текучести магниевых сплавов значительно повышается с помощью термомеханической обработки, которая состоит в пластической деформации закаленного сплава перед его старением.
- При старении временное сопротивление (sв) деформированных сплавов возрастает на 10-30%, а литых – на 30-60%.
- Из других видов термической обработки к магниевым сплавам, как и к алюминиевым, применимы различные виды отжига: гомогенизация, рекристаллизационный отжиг и отжиг для снятия напряжений.
Слитки и фасонные отливки подвергают диффузионному отжигу (гомогенизации) обычно при 400-490 °С в течение 10-24 ч. При гомогенизации магниевых сплавов избыточные фазы, выделившиеся по границам зерен, растворяются, и состав по объему зерен выравнивается, что облегчает обработку давлением и повышает механические свойства.
Для деформируемых сплавов диффузионный отжиг совмещают с нагревом для горячей обработки давлением.
Температура рекристаллизации магниевых сплавов в зависимости от их состава находится в интервале 150-300°С, а отжига для устранения наклепа и уменьшения анизотропии механических свойств – соответственно в интервале 250-350°С. Более высокие температуры вызывают рост зерна и снижение механических свойств.
Отжиг для снятия остаточных напряжений проводят при температурах ниже температуры рекристаллизации.
ТОРИЙ
Содержание статьи
ТОРИЙ – Th (Thorium), химический элемент III группы периодической системы элементов, металл, относится к актиноидам, атомный номер 90, атомная масса 232,0381.
Торий радиоактивен, стабильных изотопов не имеет, наиболее долгоживущие изотопы 230Th (период полураспада 7,5·104 лет) и 232Th (период полураспада 1,4·1010 лет).
В природе наиболее распространен изотоп 232Th, его содержание в земной коре 8·10-4%.
Впервые торий выделен И.Берцелиусом в 1828 из минерала, позже получившим название торит (содержит сульфат тория), торий был назван его первооткрывателем по имени бога грома Тора в скандинавской мифологии. См. также СКАНДИНАВСКАЯ МИФОЛОГИЯ.
Интерес к соединениям тория возник после того, как в 1885 венский химик Ауэр фон Вельсбах (первооткрыватель химического элемента неодима) обнаружил, что если ввести в пламя газовой горелки оксид тория, то он очень быстро нагревается до состояния белого каления и испускает яркий белый свет.
Обнаруженное явление позволяло простым способом превращать часть тепловой энергии газовой горелки в световую.
В результате поиска минералов, содержащих торий в заметном количестве, на берегу Атлантического океана в Бразилии был обнаружен минерал монацит, представлявший собой смесь фосфатов церия, лантана и тория, содержание тория в нем достигало 10%.
Добыча не составляла труда, монацитовый песок лежал прямо на берегу. Тысячи тонн этого минерала стали отправлять на океанских кораблях из Бразилии в Европу на переработку. Позже залежи моноцита были найдены США, Индии и на островах Цейлон и Мадагаскар.
Одновременно с этим была разработана своеобразная технология, позволяющая помещать соединения тория в горелку: из легкой ткани изготавливали тонкие колпачки, которые пропитывали солями тория, затем волокна ткани осторожно выжигали и получали легкую скорлупку, которую помещали в пламя газовой горелки.
Такие колпачки по имени их создателя стали называть ауэровскими. Тусклое газовое освещение городов Европы изменилось коренным образом, вместо желтоватого неровного пламени газового рожка появился источник яркого белого света.
Ауэровские колпачки почти в 20 раз увеличили яркость газового освещения и втрое снизили его стоимость. Производство таких колпачков в отдельные годы достигало 300 миллионов штук (в 1910-ые газовое освещение стало вытесняться электрическим).
Фактически торий был первым радиоактивным элементом, появившимся почти в каждом доме, но из-за слабой радиоактивности угрозы для здоровья он не представлял.
Физические свойства
Серебристо-белый пластичный металл, образует сплавы со многими металлами. Температура плавления – 1750° С, температура кипения – 4200° С, плотность – 7,24 г/см3, при температуре ниже 1,4 К становится сверхпроводником.
Химические свойства
Торий весьма реакционноспособен – быстро тускнеет на воздухе, в кипящей воде покрывается пленкой ThO2. Мелкодисперсный металлический торий вспыхивает на воздухе из-за энергичного окисления. Торий растворим в разбавленных минеральных кислотах: соляной, азотной, серной; концентрированной азотной кислотой он пассивируется, не реагирует со щелочами.
Наиболее устойчивая степень окисления у Th(IV), есть и соединения с более низкой степенью окисления: Th(II)I2 и Th(III)I3. При участии ионов щелочных металлов соединения тория легко образуют двойные соли K2[Th(NO3)6], Na2[Th(SO4)3], а также смешанные оксиды К2ТhO3.
В водных растворах ионы тория образуют гидроксо-ионы [Th(OH)3]+, [Th2(OH)2]6+, [Th4(OH)12]4+
Получение
Содержащие торий минералы, например, монацитовый песок, подвергают сернокислотному расщеплению, полученную пасту нейтрализуют и затем обрабатывают соляной кислотой.
Отделение сопутствующих элементов основано на различной растворимости полученных хлоридов. Иногда используют экстракцию трибутилфосфатом, позволяющую более тонко отделить примеси.
Металлический торий получают из ThCl4 восстановлением с помощью Na, Са или Mg при 900–1000° С.
Соединения тория
При нагревании тория в атмосфере водорода при 400–600 °С образуется гидрид ThH2 Темно-серые кристаллы, быстро разлагающиеся при действии влаги воздуха с образованием диоксида.
Диоксид ТhO2 образуется при сгорании металла на воздухе, при прокаливании гидроксида, а также некоторых солей – нитрата, карбоната. Это исключительно высокоплавкое соединение – т. пл. 3350° С, т. кип. 4400° С; реагирует с оксидами металлов при 600–800° С, образуя двойные оксиды (тораты), например, К2ТhO3, BaThO3, ThTi2O6. ТhO2устойчив к действию кислот и восстановителей;
Гидроксид Th(ОН)4 получают взаимодействием солей тория с растворами щелочей. Аморфное вещество; устойчиво при 260–450° С, выше 470° С превращается в ThO2.
Монокарбид ThC получают взаимодействием металлического тория со стехиометрическим количеством углерода, его т. пл. 2625° С.
Дикарбид ThC2 получают взаимодействием металлического тория с избытком углерода или восстановлением ТhО2 углеродом при 1500° С. Его т. пл. 2655° С, т. кип.
5000° С, разлагается водой и разбавленными кислотами с образованием углеводородов, на воздухе окисляется при 600–700° С до ThO2.
Тетрагалогениды ТhНа14 (Hal = F, Cl, Br, I) получают при нагревании металлического тория или ThO2 при 300–400° С с соответствующим галогенидами или галогенводородами. Тетрафторид ThF4 имеет т. пл. 1100° С, т. кип.
1650° С, растворим в воде, образует кристаллогидраты. Тетрахлорид ThCl4 имеет т. пл. 770° С, т. кип. 921° С, растворим в воде, низших спиртах, эфирах, ацетоне, бензоле. Образует гидраты с 2, 4, 7 и 12 молекулами воды.
Тетрабромид ThBr4 имеет т. пл. 679° С, т. кип. 857° С, образует гидраты с 7, 8, 10 и 12 молекулами воды, а также сольваты с аммиаком и аминами. Тетраиодид ThI4 имеет т. пл. 566° С, т. кип. 837° С, хорошо растворим в воде с образованием гидратов, при нагревании и действии света разлагается с выделением I2.
Применение
Торий используется в качестве легирующей добавки, упрочняющей магниевые сплавы, введение тория в состав вольфрамовых нитей для электроламп накаливания увеличивает срок их службы.
Оксид тория применяется как огнеупорный материал, в качестве компонента катализаторов, его также добавляют в состав дуговых углей для увеличения яркости электрической дуги, используемой в прожекторах. Фактически, это продолжение идеи «ауэровских колпачков».
В последние годы Ауэровские колпачки вновь «вернулись к жизни». Для тех, кто длительно работает в полевых условиях, в экспедициях, а также для туристов выпускают газовые баллончики с прикрепленной горелкой, поверх которой располагают Ауэровский колпачок, прикрытый стеклянным плафоном.
Подобные источники света намного экономичнее электрических светильников такой же яркости, использующих батареи или аккумуляторы. В настоящее время торий рассматривают как перспективное ядерное топливо.
При облучении нейтронами в уран-ториевых реакторах изотоп 232Тh превращается в делящийся изотоп урана 233U, пригодный для использования в ядерных реакторах.
Запасы тория в земной коре (3,3 × 106 т) соизмеримы с запасами урана (3,5 × 106 т).
Михаил Левицкий
Торий
Торий (лат. Thorium), Th, радиоактивный химический элемент, первый член семейства актиноидов, входящих в III группу периодической системы Менделеева; атомный номер 90, атомная масса 232,038; серебристо-белый пластичный металл.
Природный Торий практически состоит из одного долгоживущего изотопа 232Th — родоначальника одного из радиоактивных рядов — с периодом полураспада Т½ = 1,39·1010 лет (содержание изотопа 228Th, находящегося с ним в равновесии, ничтожно — 1,37·10-8 %) и четырех короткоживущих изотопов, два из которых относятся к радиоактивному ряду урана — радия: 234Th (Т½ = 24,1 сут) и 230Th (Т½ = 8,0·104 лет), остальные — к ряду актиния: 23lTh (Т½ = 25,6 ч) и 227Th (Т½= 18,17 сут). Из искусственно полученных изотопов наиболее устойчив 229Th (Т½ = 7340 лет).
Торий открыт в 1828 году Й. Я. Берцелиусом в одном из сиенитов в Норвегии. Элемент назван по имени бога грома в скандинавской мифологии — Тора, а минерал — силикат тория — торитом.
Распространение Тория в природе
Торий — характерный элемент верхней части земной коры — гранитного слоя и осадочной оболочки, где его в среднем содержится соответственно 1,8·10-3% и 1,3·10-3% по массе. Торий сравнительно слабомигрирующий элемент; в основном он участвует в магматических процессах, накапливаясь в гранитах, щелочных породах и пегматитах. Способность к концентрации слабая.
Известно 12 собственных минералов Торий. Торий содержится в монаците, уранините, цирконе, апатите, ортите и других. Основной промышленного источник Тория — монацитовые россыпи (морские и континентальные). В природных водах содержится особенно мало Тория: в пресной воде 2·10-9%, в морской воде 1·10-9%.
Он очень слабо мигрирует в биосфере и гидротермальных растворах.
Физические свойства Тория
Торий существует в виде двух модификаций: α-формы с гранецентрированной кубической решеткой при температуре до 1400 °С (а = 5,086 Å) и β-формы с объемноцентрированной кубической решеткой при температуре выше 1400 °С (а = 4,11 Å). Плотность Тория (рентгенографическая) 11,72 г/см3 (25 °С); атомный диаметр в α-форме 3,59 Å, в β-форме 3,56 Å; ионные радиусы Th3+ 1,08 Å, Th4+ 0,99 Å; tпл 1750 °С; tкип3500-4200 °С.
Мольная теплоемкость Тория 27,32 кдж/(кмоль·К) [6,53 кал/(моль·°С)] при 25 °С; теплопроводность при 20 °С 40,19 Вт/(м·К) [0,096 кал/(см·сек·°С)]; температурный коэффициент линейного расширения 12,5·10-6 (25-100 °С); удельное электросопротивление 13·10-6 — 18·10-6 ом·см (25 °С); температурный коэффициент электросопротивления 3,6·10-3-4·10-3. Торий парамагнитен; удельная магнитная восприимчивость 0,54·10-6 (20 °С). При 1,4К переходит в состояние сверхпроводимости.
Торий легко деформируется на холоду; механические свойства Тория сильно зависят от его чистоты, поэтому предел прочности при растяжении Тория варьирует от 150 до 290 Мн/м2 (15-29 кгс/мм2), твердость по Бринеллю от 450 до 700 Мн/м2 (45-70 кгс/мм2). Конфигурация внешних электронов атома Th 6d27s2.
Химические свойства Тория
Хотя Торий относится к семейству актиноидов, однако по некоторым свойствам он близок также к элементам второй подгруппы IV группы периодической системы Менделеева — Ti, Zr, Hf. В большинстве соединений Торий имеет степень окисления +4.
На воздухе при комнатной температуре Торий окисляется незначительно, покрываясь защитной пленкой черного цвета; выше 400 °С быстро окисляется с образованием ThO2 — единственного оксида, который плавится при 3200 °С и обладает высокой химические устойчивостью. Получают ThO2 термическим разложением нитрата, оксалата или гидрооксида Тория.
С водородом при температурах выше 200 °С Торий реагирует с образованием порошкообразных гидридов ThH2, ТhН3 и другого состава. В вакууме при температуре 700-800 °С из Тория можно удалить весь водород. При нагревании в азоте выше 800 °С образуются нитриды ThN и Th2N3, которые разлагаются водой с выделением аммиака.
С углеродом образует два карбида — ThC и ThC2; они разлагаются водой с выделением метана и ацетилена. Сульфиды ThS, Th2S3, Th7S12, ThS2 могут быть получены при нагревании металла с парами серы (600-800 °С). Торий реагирует с фтором при комнатной температуре, с остальными галогенами — при нагревании, с образованием галогенидов типа ThX4 (где X — галоген).
Наиболее важное промышленное значение из галогенидов имеют фторид ThF4 и хлорид ТhCl4. Фторид получают действием HF на ThO2 при повышенных температурах; хлорид — хлорированием смеси ThO2 с углем при повышенных температурах. Фторид малорастворим в воде и минеральных кислотах; хлорид, бромид и иодид — гигроскопичны и хорошо растворимы в воде.
Для всех галогенидов известны кристаллогидраты, выделяемые кристаллизацией из водных растворов.
Компактный Торий при температурах до 100 °С медленно корродирует в воде, покрываясь защитной оксидной пленкой. Выше 200 °С активно реагирует с водой с образованием ThO2 и выделением водорода.
Металл на холоду медленно реагирует с азотной, серной и плавиковой кислотами, легко растворяется в соляной кислоте и царской водке. Соли Тория образуются в виде кристаллогидратов.
Растворимость солей в воде различна: хорошо растворимы нитраты Th(NO3)4·nH2O; труднорастворимы сульфаты Th(SO4)2·nH2O, основной карбонат ThOCO3·8Н2О, фосфаты Th3(PO4)4·4Н2О и ThP2O7·2H2O; практически нерастворим в воде оксалат Th(C2O4)2·6H2O. Растворы щелочей слабо действуют на Торий.
Гидрооксид Th(OH)4осаждается из солей Тория в интервале рН = 3,5-3,6 в виде аморфного осадка. Для ионов Th4+ в водных растворах характерна ярко выраженная способность к образованию комплексных соединений и двойных солей.
- Получение Тория
- Торий извлекается главным образом из монацитовых концентратов, в которых он содержится в виде фосфата. Промышленное значение имеют два способа вскрытия (разложения) таких концентратов:
- 1) обработка концентрированной серной кислотой при 200 °С (сульфатизация);
2) обработка растворами щелочи при 140 °С. В сернокислые растворы продуктов сульфатизации переходят все редкоземельные элементы, Торий и фосфорная кислота.
При доведении рН такого раствора до 1 осаждается фосфат Тория; осадок отделяют и растворяют в азотной кислоте, а затем нитрат Тория экстрагируют органических растворителем, из которого Торий легко вымывается в виде комплексных соединений.
При щелочном вскрытии концентратов в осадке остаются гидрооксиды всех металлов, а в раствор переходит тринатрийфосфат. Осадок отделяют и растворяют в соляной кислоте; понижая рН этого раствора до 3,6-5, осаждают Торий в виде гидрооксида.
Из выделенных и очищенных соединений Тория получают ThO2, ThCl4 и ThF4 — основные исходные вещества для производства металлического Тория металлотермическими методами или электролизом расплавленных солей.
К металлотермическим методам относятся: восстановление ThO2 кальцием в присутствии СаCl2 в атмосфере аргона при 1100-1200 °С, восстановление ТhCl4 магнием при 825-925 °С и восстановление ThF4 кальцием в присутствии ZnCl2 с получением сплава Тория и последующим отделением цинка нагреванием сплава в вакуумной печи при 1100 °С.
Во всех случаях получают Торий в форме порошка или губки. Электролиз расплавленных солей ведется из электролитов, содержащих ThCl4 и NaCl, или ванн, состоящих из смеси ThF4, NaCl, KCl. Торий выделяется на катоде в виде порошка, отделяемого затем от электролита обработкой водой или разбавленными щелочами. Для получения компактного Торий применяют метод порошковой металлургии (спекание заготовок ведут в вакууме при 1100-1350 °С) или плавку в индукционных вакуумных печах в тиглях из ZrO2 или ВеО. Для получения Тория особо высокой чистоты используют метод термической диссоциации иодида Тория.
Применение Тория
Торированные катоды применяются в электронных лампах, а оксидно-ториевые — в магнетронах и мощных генераторных лампах. Добавка 0,8-1% ThO2 к вольфраму стабилизирует структуру нитей ламп накаливания.
ThO2 используют как огнеупорный материал, а также как элемент сопротивления в высокотемпературных печах.
Торий и его соединения широко применяют в составе катализаторов в органических синтезе, для легирования магниевых и других сплавов, которые приобрели большое значение в реактивной авиации и ракетной технике. Металлический Торий используется в ториевых реакторах.
При работе с Торий необходимо соблюдать правила радиационной безопасности.
Торий в организме
Торий постоянно присутствует в тканях растений и животных. Коэффициент накопления Тория (т. е. отношение его концентрации в организме к концентрации в окружающей среде) в морском планктоне — 1250, в донных водорослях — 10, в мягких тканях беспозвоночных — 50-300, рыб — 100.
В пресноводных моллюсках (Unio mancus) его концентрация колеблется от 3·10-7 до 1·10-5 %, в морских животных от 3·10-7 до 3·10-6%.
Торий поглощается главным образом печенью и селезенкой, а также костным мозгом, лимфатическими железами и надпочечниками; плохо всасывается из желудочно-кишечного тракта.
У человека суточное поступление Тория с продуктами питания и водой составляет 3 мкг; выводится из организма с мочой и калом (0,1 и 2,9 мкг соответственно). Торий — малотоксичен, однако как природный радиоактивный элемент вносит свой вклад в естественный фон облучения организмов.
Торий химический элемент
(Thorium; по имени древнескандинавского бога-громовержца Тора), Th — радиоактивный хим. элемент III группы периодической системы элементов; ат. н. 90, ат. м. 232,0381; относится к актиноидам. Светло-серый металл.
В соединениях проявляет степень окисления преим. + 4, а также + 2 и +3. Природный торий состоит практически из изотопа 232Th с периодом полураспада 1,39 X 10 10 лет. Известно 13 изотопов тория с массовыми числами 223—235. Торий открыл (1828) швед, химик Й. Я.
Берцелиус в минерале торите ThSiО4.
Содержание в земной коре 8х10-4%. Торий обнаружен более чем в 120 минералах, из к-рых монацит служит главным источником его получения. Торий — полиморфный металл.
Низкотемпературная альфа-модификация тория, имеющая гранецентрированную кубическую решетку с периодом а = 5,086 А (т-ра 25° С), превращается при т-ре 1360° С в бета-модификацию с объемноцентрированной кубической решеткой и периодом а = 4,11 А (т-ра 1450° С).
Плотность (т-ра 25° С) 11,72 г/см3; tпл 1750° С.
Теплоемкость (температура 27° С) 6,54 ккал/моль • град; коэфф. теплопроводности (т-ра 110° С) 0,090 кал/ см-сек град; ср. коэфф. линейного расширения 11,55 • 10-6 град-1 в интервале т-р 30—200° С; удельное электрическое сопротивление (т-ра 20° С) 13 мком • см.
При температуре ниже 1,3—1,4 К металл становится сверхпроводником. Работа выхода электронов 3,51 эв. Магнитная восприимчивость 0,54 • 10-6 э.м.е./г (т-ра 20° С). При комнатной т-ре модуль нормальной упругости 7000 кгс/мм2, модуль сдвига 2800 кгс/мм2; коэфф. Пуассона 0,27. Наиболее чистый йодидный торий малопрочен и пластичен при комнатной т-ре.
В деформированном и отожженном при т-ре 650° С состоянии его предел прочности на растяжение 12,2 кгс/мм2 , относительное удлинение 36%; относительное сужение 62%; HV = 45.
Менее чистый спеченный из электролитического порошка торий, деформированный и затем отожженный, имеет предел прочности на растяжение 16,6 кгс/мм2; предел текучести 8,0 кгс/мм2; относительное удлинение 35%; НУ = 53,0.
Растворение углерода в тории существенно повышает его прочность. Вследствие малой растворимости кислорода и азота в торий их примеси почти не влияют на его механические свойства. Йодидный торий не переходит в хрупкое состояние. При содержании 0,05% С переход в хрупкое состояние наблюдается ниже т-ры 0°С.
Торий в порошкообразном состоянии пирофорен на воздухе и кислороде . Компактный металл реагирует с кислородом медленно при т-ре 250° С и быстро при т-ре 450° С. Торий образует нитрид Th2N3 и гидрид ТhН2. Т.
не корродирует в дистиллированной воде до т-ры 100° С, устойчив в расплавленных щелочных металлах, не содержащих кислород.
Металлический торий, его сплавы с ураном или плутонием (до 10—15%) обладают большой стабильностью размеров при облучении нейтронами.
Торий получение
Нейтронное облучение упрочняет металл. Торий извлекают из обогащенных монацитовых руд, обрабатывая их концентрированной серной кислотой или крепким раствором едкого натра при т-ре 140—200° С. Полученные растворимые соединения тория отделяют селективным растворением и осаждением либо экстракцией органическими растворителями.
Проверь хорошо ли Вы знаете науки
Вопрос
Ваш ответ:
Правильный ответ:
Ты получил {{SCORE_CORRECT}} снаружи {{SCORE_TOTAL}}
Конечным продуктом химической переработки руды является окись тория или его галогениды. Торий в виде порошка чистотой 99,6—99,8% получают кальциетермическим восстановлением окиси тория в присутствии хлористого кальция (т-ра 1100— 1200° С). Губчатый торий получают восстановлением ThF4 кальцием с добавкой ZnCl2.
Восстановление до металла осуществляют также электролизом ThF4 или KThF5 в расплаве хлоридов щелочных металлов при т-ре 750—800° С, что дает возможность получить порошок тория чистотой более 99,9%. Очень чистый металлический торий получают йодидным рафинированием. Высокая температура плавления и химическая активность тория затрудняют его плавку и литье.
Плавят торий в дуговых печах с медным охлаждаемым водой тиглем-кристаллизатором в вакууме или среде инертного газа. Выплавленный в дуговой печи йодидный торий можно прокатывать в холодном состоянии со степенью обжатия до 99% без промежуточных отжигов и растрескивания. Прутки и трубы из ториевых слитков изготовляют горячим прессованием.
Металлический торий обладает низкими антифрикционными свойствами и склонен к налипанию на рабочие поверхности инструмента. Рекристаллизационный отжиг после холодного деформирования осуществляют при т-ре 650—750° С (1 ч) для кальциетермического металла и при т-ре 600—700° С для йодидного. Плакируют торий алюминием или цирконием в процессе прессования или прокатки .
При работе с торием необходимо соблюдение правил безопасности, предусмотренных для радиоактивных и пирофорных веществ. Торий применяют для легирования магниевых сплавов, для увеличения их прочности при повышенных т-рах, как присадочный материал при сварке молибдена с целью повышения пластичности шва.
При изготовлении электровакуумных приборов используют торированный вольфрам (1—2 % Th02). Окись тория или ее смесь с окислами др. металлов применяют в качестве катализаторов окисления, гидрогенизации и крекинга.
Из ThО2 изготовляют тигли, стойкие в расплавах химически активных металлов, и высокотемпературные керамические нагреватели (95% Th02 + 5% Y2о3 или La2О8; 85% ThО2 + 15% CeО2).
Перспективно применение тория в качестве ядерного горючего.
Статья на тему Торий химический элемент
Торий
ТОРИЙ, Th (от имени бога грома Тоpa в скандинавской мифологии; лат. Thorium * а. thorium; н. Thorium; ф. thorium; и. torio),- радиоактивный химический элемент III группы периодической системы Менделеева, атомный номер 90, атомная масса 232,0381, относится к актиноидам.
Природный торий состоит главным образом из одного изотопа 232Th (ТЅ 14,00•109 лет). В незначительных количествах присутствуют также 228Th (ТЅ 1,913 года) и четыре короткоживущих изотопа. Известно 18 искусственных изотопов тория с массовыми числами от 213 до 236.
Торий открыт в 1828 шведским химиком И. Я. Берцелиусом.
Свойства тория
В свободном состоянии торий — серебристо-белый пластичный металл, для которого при температурах ниже 1365°С характерна гранецентрированная кубическая решетка (а=0,5086 нм) — а-Th, а при более высоких — объёмноцентрированная кубическая (а=0,411 нм) — Я-Th.
Плотность 11300 кг/м3, t плавления 1750°С, t кипения 4200°С, молярная теплоёмкость 27,33 Дж/(моль•К), удельное электрическое сопротивление 18,62•10-4 (Ом•м), температурный коэффициент линейного расширения 11,3•10-6 К-1, теплопроводность 35,6 Вт/(м•К).
Парамагнитен, температура перехода в сверхпроводящее состояние 1,4 К. Легко деформируется на холоде.
Торий химический
В большинстве соединений для тория характерна степень окисления +4, но бывает также +2 и +3. Порошкообразный торий пирофорен, на воздухе тускнеет, в кипящей воде покрывается плёнкой диоксида.
Реагирует со фтором, при нагревании — с водородом, хлором, бромом, серой, фосфором, азотом, сероводородом. Легко растворяется в соляной кислоте и царской водке, медленно — в азотной, серной и фтористоводородной кислотах.
Токсичен, ПДК 0,05 мг/м3.
Торий в природе
Среднее содержание тория в земной коре 1,3•10-3% по массе, причём магматические горные породы (кислые) и осадочные (1,8•10-3% и 1,1•10-3%, соответственно) содержат значительно больше тория, чем магматические средние (7•10-4%), основные (3•10-4%) и особенно ультраосновные горные породы (5•10-7%). Известно около 120 минералов, содержащих торий, главные из которых — торит, торианит, монацит, ортит, циркон, апатит. Природные воды содержат очень мало тория (1-2•10-9%), в связи с чем торий слабо мигрирует в гидро- и биосфере.
Извлекают торий главным образом из монацитовых россыпей. Металлический торий получают, используя кальциетермическое восстановление или электролиз ThO2, ThCl4 и ThF4.
Применение и использование
Торий применяют в электронной и электротехнической промышленности для изготовления катодов и нитей накаливания электроламп, в качестве катализатора в органическом синтезе, для легирования магниевых сплавов, используемых в ракетной и авиационно-космической технике.
Магний и его сплавы
СВОЙСТВА И ПРИМЕНЕНИЕ МАГНИЯ
Магний (Mg) впервые обнаружен в 1828 г. в соединениях, найденных вблизи греческого города Магнезий. В природе он встречается только в связанном состоянии и относится к числу наиболее распространенных металлов.
На долю магниевых соединений приходится более 12% от общего количества известных минералов. Так же, как и алюминий, магний обладает высокими значениями теплоемкости, скрытой теплоты плавления, электропроводности и невысокой температурой плавления.
Важнейшим свойством машин является малая плотность.
Магний обладает большой химической активностью по отношению к кислороду. В виде порошка или ленты магний легко загорается на воздухе, давая яркое ослепительное пламя.
В атмосферных условиях он имеет удовлетворительную коррозионную стойкость, однако в присутствии влаги быстро корродирует. Магний реагирует с водой, образуя осадок гидроокиси. Он значительно корродирует в морской воде к 3%-ном растворе хлористого натрия.
Сильно действуют на магний разбавленные минеральные кислоты (кроме плавиковой), а также большинство органических кислот.
Магний устойчив против воздействия растворов едких щелочей, фтористых солей, плавиковой кислоты, а также по отношению к спиртам (за исключением метилового), керосину, бензину, фреону и минеральным маслам. Он является энергичным восстановителем и вытесняет менее активные металлы из их соединений.
Магний отлично обрабатывается резанием, но механические и литейные свойства его невысоки, что исключает применение его в качестве конструкционного материала.
Со многими металлами магний образует сплавы, которые обладают более высокими по сравнению с чистым магнием механическими свойствами и коррозионной стойкостью, что значительно расширяет область применения магния.
Легкие магниевые сплавы используют в качестве конструкционного материала для различных частей самолетов, а также железнодорожного и автомобильного транспорта.
Детали из магниевых сплавов, полученные литьем под давлением, применяют в производстве оптических и точных приборов.
Магниевый порошок служит высококалорийным топливом в ракетной технике, в химической промышленности его используют для обезвоживания органических веществ и для синтеза сложных органических веществ.
Магний применяют также в качестве раскислителя в производстве стали и цветного литья, для получения трудновосстановимых металлов и их сплавов, для модифицирования чугуна, в качестве материала для анодов при катодной защите от коррозии стальных изделий и конструкций. Ниже приводятся физические и механические свойства магния:
| Атомная масса | 24,32 |
| Плотность при 20°С, г/см3 | 1,74 |
| Температура, °С: | |
| плавления | 650 |
| кипения | 1107 |
| Удельная теплоемкость, кал/г | 0,25 |
| Теплопроводность кал/(см·сек·град) | 0,37 |
| Скрытая теплота плавления, кал/г | 70 |
| Коэффициент линейного расширения, 1 /град | 25,5*10-6 |
| Удельное электросопротивление, ом-мм2/м | 0,047 |
| Временное сопротивление при растяжении магния, кГ/мм2 | |
| литого | 8,5-13 |
| деформированного | 25 |
| отожженного | 18 |
| Предел текучести , кГ/мм2, | |
| Литого магния | 2,1 |
| Деформированного магния | 18,9 |
| Отожженного магния | 9,8 |
| Относительное удлинение магния, %: | |
| литого | 3-6 |
| Деформированного | 8-10 |
| отожженного | 15-17 |
| Предел упругости магния, кГ/мм2: | 1,2 |
| Модуль упругости, кГ/мм2 | 4360 |
| Модуль сдвига, кГ/мм2 | 1700 |
| Предел усталости отожженного магния базе 50*107 циклов, кГ/мм2 | 6,3 |
| Твердость НВ магния, кГ/мм2 | |
| литого | 25-30 |
| Деформированного | 50 |
| отожженного | 40 |
МАГНИЕВЫЕ СПЛАВЫ
В качестве основных легирующих элементов сплавы па магниевой основе содержат алюминий и цинк, которые значительно улучшают механические свойства магния.
Марганец повышает коррозионную стойкость магниевых сплавов и способствует измельчению зерна, поэтому он присутствует во многих магниевых сплавах, а в сплаве Мл2 является основным легирующим элементом.
Введение в магниевые сплавы титана и селена (до 0,5%) повышает пластичность сплавов и способствует измельчению зерна.
Бериллий, в небольших количествах, создает окисную пленку и предохраняет его от дальнейшего окисления.
Примеси калия, натрия, никеля, меди, железа в магниевых сплавах относятся к числу вредных примесей.
Растворимость элементов, образующих с магнием сплавы, изменяется с изменением температуры. Это позволяет применять к магниевым сплавам упрочняющую термическую обработку.
Магниевые сплавы разделяют на литейные, предназначенные для производства отливок, и деформируемые.
В зависимости от механических свойств литейные сплавы можно условно разделить на три группы: средней прочности, высокопрочные и жаропрочные.
Сплавы средней прочности имеют временное сопротивление не менее 16 кГ/мм2. К ним относятся сплавы магния с алюминием и цинком типа Мл3. Сплавы этой группы не упрочняются термической обработкой.
Для снятия внутренних напряжений детали сложной формы из указанных сплавов подвергают отжигу при 325°С. Сплавы средней прочности обладают удовлетворительной коррозионной стойкостью.
Для повышения коррозионной стойкости детали из этих сплавов подвергают оксидированию.
Наибольшее применение из этой группы сплавов имеет сплав Мл6, в котором сочетаются высокие механические и технологические свойства.
Из этого сплава изготовляют детали летательных аппаратов, детали колес, детали управления и крыла самолета, корпусы агрегатов, маслопомпы; в автомобильной промышленности — отливки картера двигателя, коробки передач, детали автомобильных колес; в тракторной промышленностикорпусы коробок передачи т. д.
Сплав Мл4 превосходит сплав Мл5 по коррозионной стойкости. Однако он обладает ограниченной свариваемостью, повышенной склонностью к образованию горячих трещин и микрорыхлоты в отливках, а также пониженной герметичностью и поэтому имеет ограниченное применение.
Применяют сплав Мл4 главным образом для протекторной защиты в судостроении. Для отливок рекомендуется использовать песчаные формы. Для литья в кокиль и под давлением этот сплав не пригоден. Из высокопрочных сплавов машин с алюминием и цинком сплав Мл6 имеет самое высокое временное сопротивление.
Пластичность сплава при комнатной температуре низкая.
Сплав Мл6, так же как и сплав Мл5, обладает хорошими литейными свойствами и применяется для получения сложных крупногабаритных отливок.
Сплав Мл12 при высоком пределе текучести обладает более высокой пластичностью по сравнению со сплавами Мл5 и Мл6. Это позволяет использовать его в условиях статических и знакопеременных нагрузок. По сравнению со сплавом Мл6 он имеет повышенную склонность к образованию горячих трещин при литье тонкостенных деталей.
Сплав Мл15 по пластичности при комнатной температуре занимает промежуточное положение между сплавами Мл12 и Мл6.
Сплав Мл 15, легированный лантаном, превосходит сплав Мл 12 по пределам ползучести и длительной прочности и является самым жаропрочным из всех магниевых литейных сплавов высокой прочности.
По литейным свойствам сплав Мл1б также превосходит сплав Мл12, отливки из него характеризуются высокой пластичностью.
Технологические свойства сплавов Мл 12 и Мл 15 зависят от содержания в них циркония. Наилучшие свойства достигаются при содержании циркония 0,8%. Магниевые жаропрочные литейные сплавы предназначаются для отливки деталей, работающих при 250—350°С и кратковременно при 350— 400°С. К этой группе сплавов относятся сплавы магния с РЗМ и Zr.
Магниевые литейные коррозионностойкие сплавы по коррозионной стойкости превосходят сплав Мл5. К ним относятся сплавы Мл4пч, Мл5пч, Мл2, а также сплавы магния с цирконием.
Повышение коррозионной стойкости деталей из сплавов Мл4пч и Млбпч по сравнению со сплавами Мл4 и Мл6 достигается ограничением содержания вредных примесей и применением при литье бесхлоридных флюсов вместо хлористых флюсов.
При этом получают отливки, практически свободные от включений хлористых флюсов, образующих с влагой, концентрированные растворы хлористых солей, разрушающих магниевые сплавы.
Сплавы Мл4пч и Мл5пч применяют для изготовления высоконагруженных деталей, длительно работающих в тяжелых условиях, в том числе в атмосферных условиях повышенной влажности.
Сплав Мл2 способен противостоять действию концентрированных растворов едкого натра при температурах до 120°С и растворов соды. Негашеная известь, известковые растворы и бетон разрушают отливки из сплава Мл2 очень медленно.
Применение сплава Мл2 ограничивается из-за его низких (механических и технологических свойств.
Применяют этот сплав для изготовления малонагруженных деталей простой конфигурации — баков, бензо-масляной арматуры, а также деталей, работающих в щелочной среде.
Магниевые деформируемые сплавы. Эти сплавы подвергаются прокатке, прессованию, ковке и штамповке.
К ним относятся сплавы, легированные алюминием, цинком, марганцем, цирконием, редкоземельными элементами, торием и другими металлами.
Их применяют для изготовления деталей механической обработкой, сваркой и клепкой, объемной и листовой штамповкой. Из них делают прессованные прутки, полосы, профили и трубы, катаные плиты и листы, поковки и штамповки.
Сплавы магния с марганцем, содержащие марганца в пределах 1,3—2,5%, отличаются наиболее высокой коррозионной стойкостью, хорошей свариваемостью и высокой пластичностью.
По механическим свойствам они относятся к сплавам низкой прочности с временным сопротивлением 17—23 кГ/мм2.
Из этих сплавов изготовляют листы толщиной 0,8—10 мм, прессованные прутки диаметром до 130 мм, прессованные профили, поковки и штамповки.
Магниевые деформируемые сплавы с марганцем и небольшой добавкой церия (МА8), а также спла(в магния с алюминием, цинком и марганцем (МА2) относятся к группе сплавов средней прочности (временное сопротивление 23—26 кГ/мм2).
Они обладают хорошей технологической пластичностью в нагартованном состоянии, достаточной для изготовления из них листов и всех других видов деформируемых полуфабрикатов, а также удовлетворительной общей коррозионной стойкостью. Сплав МА8 не подвержен коррозии .
под напряжением, а сплав МА2 имеет незначительную склонность к коррозионному растрескиванию под напряжением. Для защиты сплавов этой группы от коррозии применяют покрытия неорганическими пленками и лакокрасочные покрытия.
Сплавы средней прочности термической обработкой не упрочняются. Они удовлетворительно свариваются аргонодуговой и контактной электросваркой. Детали из сплава МА2 могут работать при темпераiypax до 150°С, а из сплава МА8 — до 200—250°С.
Сплавы магниевые деформируемые с временным сопротивлением 26—40 кГ/мм2 образуют группу высокопрочных сплавов. В эту группу входят сплавы MA2-1, МА5, МА14. Из сплава МА2-1 изготовляют все виды деформируемых полуфабрикатов, а из остальных сплавов — прессованные изделия и штамповки.
Общая коррозионная стойкость магниевых деформируемых сплавов высокой прочности удовлетворительная. Однако при эксплуатации детали из этих сплавов необходимо защищать неорганическими пленками и лакокрасочными покрытиями. Они обладают различной склонностью к коррозии под напряжением.
Сплав МА5 рекомендуется применять для деталей, работающих при длительно растягивающих напряжениях, не превышающих 60% предела текучести при растяжении.
Сплав MA2-1 термической обработкой не упрочняется. Сплавы МА14 и МАБ подвергают закалке на воздухе или в горячей воде и искусственному старению.
Наибольшее применение из деформируемых магниевых сплавов высокой прочности получили сплавы МА14 и МА2-1.
Сплавы типа МА2-1 применяют для обшивки, изготовления перегородок и шпангоутов, а также в виде труб и профилей для сварных конструкций и деталей, выполняемых объемной штамповкой. Из них можно изготовлять кузовы, бензобаки, приборные щитки и другие детали спортивных автомобилей.
- Сплав МА14 применяют для несвариваемых крупногабаритных нагруженных деталей, не имеющих тонких сечений.
- Сплавы MA1, МА2, МА2-4, МАБ и МА14 пригодны для работы при температурах до 150°С, а сплав МА8—при температурах до 200°С.
- не должно быть не менее 99,9%, а примесей— не более 0,1%, в том числе 0,04% Fe; 0,01% Si; 0,001% Ni; 0,005% Сu; 0,02% Al; 0,04% Μn; 0,005% Cl.
Магний поставляют в .виде чушек массой 8,0±1,0 кг или в виде слитков. Поверхность чушек магния должна быть без наплывов, неслитин, флюсовых включений и продуктов горения магния. В срезе чушек не должно быть флюсовых включений общей площадью более 4 мм2, а также других посторонних включений.