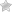Алкины во многих реакциях обладают большей реакционной способностью, чем алкены. Для алкинов, как и для алкенов, характерны реакции присоединения. Так как тройная связь содержит две π-связи, реакции присоединения к алкинам могут происходить в две стадии.
Вначале идет присоединение по месту двойной π-связи с образование производных олефинов, а затем по месту второй π-связи с образованием производных алканов.
Реакции присоединения для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что π-электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
Реакции присоединения
- 1. Гидрирование
- Присоединение водорода происходит при нагревании в присутствии металлических катализаторов. Реакция протекает в две стадии: алкины присоединяют водород с образованием алкенов (разрывается первая π-связь), а затем образованием алканов (разрывается вторая π-связь):
- 2. Галогенирование
- Присоединение галогенов протекает также в две стадии. На первой стадии образуются дигалогеналкены, на второй – тетрагалогеналканы:
Реакция алкинов с бромной водой является качественной реакцией на алкины. Бромная вода обесцвечивается.
- Видеоопыт «Взаимодействие ацетилена с бромной водой»
- Видеоопыт «Взаимодействие ацетилена с хлором»
- 3. Гидрогалогенирование
Галогеноводороды присоединяются к алкинам в две стадии. Вторая стадия идет по правилу Марковникова. Присоединение НCl в отсутствии катализатора идет очень медленно. Катализатором этой реакции служат кислоты Льюиса – соли меди (I) и ртути (II):
- Получаемый продукт – хлористый винил (винилхлорид) – подобно этилену легко полимеризуется, образуя полимер – поливинилхлорид, который широко применяется в производстве поливинилхлоридных смол:
- 4. Гидратация (реакция Кучерова)
- Присоединение воды протекает в присутствии солей ртути (II) при нагревании – HgSO4, Hg (NO3)2 – с образованием уксусного альдегида (при обычных условиях ацетилен с водой не взаимодействует):
На первой стадии реакции образуется непредельный спирт, в котором гидроксильная группа находится непосредственно у атома углерода при двойной связи. Такие спирты принято назвать виниловыми или енолами.
Отличительной чертой енолов является их неустойчивость.
В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) — водород гидроксильной группы переходит к соседнему атому углероду.
При этом π-связь между атомами углерода разрывается и образуется π-связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С=О по сравнению с двойной связью С=С.
- Гидратация гомологов ацетилена протекает по правилу Марковникова, и образующиеся енолы изомеризуются в кетоны:
- 5. Реакции полимеризации
- В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты.
- 1.Димеризация под действием водно-аммиачного раствора CuCl:
- Винилацетилен обладает большой реакционной способностью – присоединяя хлороводород, он образует хлоропрен (2-хлорбутадиен-1,3), используемый для получения искусственного хлорпренового каучука:
2.Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):- В аналогичные реакции тримеризации могут вступать также и ближайшие гомологи ацетилена, например пропин:
- Реакции окисления
- 1. Горение
- При сгорании алкинов происходит их полное окисление до СО2 и Н2О. Горение ацетилена сопровождается выделением большого количества тепла:
- Видеоопыт «Горение ацетилена»
Температура ацетиленово-кислородного пламени достигает 2800- 3000°С. На этом основано применение ацетилена для сварки и резки металла. Ацетилен образует с воздухом и кислородом взрывоопасные смеси.
Видеоопыт «Взрыв смеси ацетилена с кислородом»
В сжатом, и особенно в сжиженном, состоянии он способен взрываться от удара. Поэтому ацетилен хранится в стальных баллонах в виде растворов в ацетоне, которым пропитывают асбест.
2. Неполное окисление
Ацетилен и его гомологи легко окисляются окислителями — КMnO4, K2Cr2O7. Алкины окисляются с разрывом молекулы по тройной связи. Строение продуктов окисления зависит от природы окислителя и условий проведения реакций.
- Алкины обесцвечивают разбавленный раствор перманганата калия, что доказывает их ненасыщенность.
- а) мягкое окисление
- Мягкое окисление алкинов происходит без разрыва σ-связи С─С (разрушаются только π-связи).
- Например, при взаимодействии ацетилена с разбавленным раствором КMnO4 при комнатной температуре образуется двухосновная щавелевая кислота:
- В нейтральной и слабощелочной средах на холоде образуются соли карбоновых кислот. При взаимодействии ацетилена с водным раствором перманганата калия образуется соль щавелевой кислоты (оксалат калия):
- б) Жесткое окисление
- При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты.
- Окисление алкинов перманганатом калия в кислой среде при нагревании сопровождается разрывом углеродной цепи по месту тройной связи и приводит к образования карбоновых кислот:
- Окисление алкинов, содержащих тройную связь у крайнего атома углерода, сопровождается в этих же условиях образованием карбоновой кислоты и выделением углекислого газа:
- В кислой среде окисление ацетилена идет до щавелевой кислоты или углекислого газа:
- Видеоопыт «Взаимодействие ацетилена с раствором перманганата калия»
Реакция КMnO4 является качественной реакцией на алкины. Раствор перманганата калия обесцвечивается.
Образование солей
Особенностью алкинов, имеющих концевую тройную связь (алкины-1), является их способность проявлять слабые кислотные свойства.
Атомы водорода, связанные с sp-гибридизированными атомами углерода в молекулах алкинов, обладают значительной подвижностью, что объясняется поляризацией σ-связи ≡С─Н. В связи с этим атомы водорода могут замещаться атомами металлов, в результате чего образуются соли — ацетилениды.
- Ацетилениды щелочных и щелочноземельных металлов используются для получения гомологов ацетилена.
- Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I).
- Образование серовато- белого осадка ацетиленида серебра (или красно-коричневого – ацетиленида меди) служит качественной реакцией на концевую тройную связь.
- Видеоопыт «Получение ацетиленида серебра»
- Видеоопыт «Получение ацетиленида меди»
- Ацетилениды серебра и меди как соли слабых очень кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина.
Ацетилиниды серебра и меди в сухом виде взрываются от удара. Однако карбид кальция, который также является ацетиленидом, очень устойчив к удару. Он широко используется для получения ацетилена.
- Видеоопыт «Неустойчивость ацетиленидов»
- Если тройная связь находится не на конце цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода) и ацетилениды не образуются.
- Алкины (ацетиленовые углеводороды)
Химические свойства алкинов
- Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
- Остановимся на свойствах, способах получения и особенностях строения алкинов.
- Строение, изомерия и гомологический ряд алкинов
- Химические свойства алкинов
- Получение алкинов
Алкины – непредельные углеводороды, в молекулах которых есть одна тройная связь. Строение и свойства тройной связи определяют характерные химические свойства алкинов.
Химические свойства алкинов схожи с химическими свойствами алкенов из-за наличия кратной связи в молекуле.
Для алкинов характерны реакции окисления. Окисление алкенов протекает преимущественно по тройной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Тройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С≡С и связи С–Н:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С–С | 348 | 0,154 |
| С≡С | 814 | 0,120 |
| С–Н | 435 | 0,107 |
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С, поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Для алкинов характерны реакции присоединения по тройной связи С≡С с разрывом π-связей.
1.1. Гидрирование
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
| Например, при гидрировании бутина-2 в присутствии никеля образуется сначала бутен-2, а затем бутан. |
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
| Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1. |
1.2. Галогенирование алкинов
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкинами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на тройную связь. |
| Например, при бромировании пропина сначала образуется 1,2-дибромпропен, а затем — 1,1,2,2-тетрабромпропан. |
- Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
- Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
| Например, при взаимодействии ацетилена с хлороводородом образуется хлорэтен, а затем 1,1-дихлорэтан. |
- При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкинам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропину преимущественно образуется 2-хлорпропен. |
1.4. Гидратация алкинов
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
| Например, при взаимодействии ацетилена с водой в присутствии сульфата ртути образуется уксусный альдегид. |
- Гидратация алкинов протекает по ионному (электрофильному) механизму.
- Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
| Например, при гидратации пропина образуется пропанон (ацентон). |
1.5. Димеризация, тримеризация и полимеризация
- Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:
- Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):
- Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
- nM → Mn (M – это молекула мономера)
| Например, при полимеризации ацетилена образуется полимер линейного или циклического строения. |
… –CH=CH–CH=CH–CH=CH–…
2. Окисление алкинов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
2.1. Горение алкинов
- Алкины, как и прочие углеводороды, горят с образованием углекислого газа и воды.
- Уравнение сгорания алкинов в общем виде:
- CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O + Q
| Например, уравнение сгорания пропина: |
C3H4 + 4O2 → 3CO2 + 2H2O
2.2. Окисление алкинов сильными окислителями
Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| R-C≡ | R-COOH | -COOMe |
| CH≡ | CO2 | Me2CO3 (MeHCO3) |
- При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C≡, поэтому образуется уксусная кислота:
- При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ:
- При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
| Например, при окислении бутина-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента R–C≡, поэтому образуется соль уксусной кислоты – ацетат калия |
- Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
- Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:
- В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:
- Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
3. Кислотные свойства алкинов
Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp2 и sp3-гибридном состоянии соответственно). Это обусловлено большим вкладом s-орбитали в гибридизованное состояние.
| Гибридизация: | sp | sp2 | sp3 |
| Число s-орбиталей | 1 | 1 | 1 |
| Число p-орбиталей | 1 | 2 | 3 |
| Доля s-орбитали | 50% | 33% | 25% |
Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления протона Н+, т.е. приводит к появлению у алкинов с тройной связью на конце молекулы (алкинов-1) кислотных свойств.
| Ацетилен и его гомологи с тройной связью на конце молекулы R–C≡C–H проявляют слабые кислотные свойства, атомы водорода на конце молекулы могут легко замещаться на атомы металлов. |
Алкины с тройной связью на конце молекулы взаимодействуют с активными металлами, гидридами, амидами металлов и т.д.
| Например, ацетилен взаимодействует с натрием с образованием ацетиленида натрия. |
| Например, пропин взаимодействует с амидом натрия с образованием пропинида натрия. |
- Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным раствором хлорида меди (I).
- При этом образуются нерастворимые в воде ацетилениды серебра или меди (I):
| Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра или аммиачным раствором хлорида меди (I) с образованием белого или красно-коричневого осадка соответственно. Это качественная реакция на алкины с тройной связью на конце молекулы. |
Соответственно, алкины, в которых тройная связь расположена не на конце молекулы, не реагируют с аммиачными растворами оксида серебра или хлорида меди (I).
Ацетилен, получение, свойства, химические реакции
- Ацетилен, C2H2 – органическое вещество класса алкинов, непредельный углеводород.
- Ацетилен, формула, газ, характеристики
- Физические свойства ацетилена
- Химические свойства ацетилена
- Получение ацетилена в промышленности и лаборатории
- Химические реакции – уравнения получения ацетилена
- Применение и использование ацетилена
- Взрывоопасность ацетилена и безопасность при обращении с ним
Ацетилен, формула, газ, характеристики:
Ацетилен (также – этин) – органическое вещество класса алкинов, непредельный углеводород, состоящий из двух атомов углерода и двух атомов водорода.
Химическая формула ацетилена C2H2. Структурная формула ацетилена СH≡CH. Изомеров не имеет.
Строение молекулы ацетилена:
Ацетилен имеет тройную связь между атомами углерода.
Ацетилен – бесцветный газ, без вкуса и запаха. Однако технический ацетилен содержит примеси – фосфористый водород, сероводород и пр., которые придают ему резкий запах.
Легче воздуха. Плотность по сравнению с плотностью воздуха 0,9.
Очень горючий газ. Пожаро- и взрывоопасен.
Ацетилен относится к числу немногих соединений, горение и взрыв которых возможны в отсутствии кислорода или других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа при комнатной температуре.
Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки.
Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном. В них ацетилен хранится в виде раствора с ацетоном.
Малорастворим в воде. Очень хорошо растворяется в ацетоне. Хорошо растворяется в других органических веществах (бензине, бензоле и пр.)
Ацетилен обладает незначительным токсическим действием.
Физические свойства ацетилена:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м3 | 1,0896 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 1,173 |
| Температура плавления, °C | -80,8 |
| Температура кипения, °C | -80,55 |
| Тройная точка, °C | 335 |
| Температура самовоспламенения, °C | 335 |
| Давление самовоспламенения, МПа | 0,14-0,16 |
| Критическая температура*, °C | 35,94 |
| Критическое давление, МПа | 6,26 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,1 до 100 |
| Удельная теплота сгорания, МДж/кг | 56,9 |
| Температура пламени, °C | 3150-3200 |
| Молярная масса, г/моль | 26,038 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства ацетилена:
Химические свойства ацетилена аналогичны свойствам других представителей ряда алкинов. Поэтому для него характерны следующие химические реакции:
- 1. галогенирование ацетилена:
- СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен);
- CHBr=CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-тетрабромэтан).
- Реакция протекает стадийно с образованием производных алканов.
- В ходе данной реакции ацетилен обесцвечивает бромную воду.
- 2. гидрогалогенирование ацетилена:
СH≡CH + HBr → CH2=CHBr (бромэтен).
- 3. гидратация ацетилена (реакция Михаила Григорьевича Кучерова, 1881 г.):
CH≡CH + H2O → [CH2=CH-OH] (енол) → CH3-CH=O (уксусный альдегид ) (kat = HgSO4, Hg(NO3)2).
- 4. тримеризация ацетилена (реакция Николая Дмитриевича Зелинского, 1927 г.):
3СH≡CH → C6H6 (бензол) (kat = активированный уголь, to = 450-500 оС).
Реакция тримеризации ацетилена является частным случаем реакции полимеризации ацетилена и происходит при пропускании ацетилена над активированным углем при температуре 450-500 оС.
- 5. димеризация ацетилена:
- СH≡CH + СH≡CH → CH2=CH-С≡CH (винилацетилен) (kat = водный раствор CuCl и NH4Cl).
- Реакция димеризации ацетилена является частным случаем реакции полимеризации ацетилена.
- 2СH≡CH + 5О2 → 4CО2 + 2H2О.
- Ацетилен горит белым ярким пламенем.
- Протекание реакции и её продукты определяются средой, в которой она протекает.
- 8. восстановления ацетилена:
СH≡CH + Н2 → C2H4 (этилен) (kat = Ni, Pd или Pt, повышенная to);
СH≡CH + 2Н2 → C2H6 (этан) (kat = Ni, Pd или Pt, повышенная to).
Получение ацетилена в промышленности и лаборатории. Химические реакции – уравнения получения ацетилена:
Ацетилен в лабораторных условиях получается в результате следующих химических реакций:
- 1. действия воды на карбид кальция:
CаС2 + H2О → Cа(ОH)2 + C2H2.
- 2. дегидрирования метана:
2CH4 → C2H2 + 3H2 (при to > 1500 оС).
- 3. дегидрирования этилена:
- CH2=CH2→ СH≡CH +H2 (kat = Pt, Ni, Al2O3, Cr2O3, to = 400-600 °C).
- Ацетилен в промышленности получают следующими способами и методами:
- Сначала получают известь из карбоната кальция.
CаСО3 → CаО + CO2. (to = 900-1200 оС).
Затем получают карбид кальция, сплавляя оксид кальция и кокс в электропечах при температуре 2500-3000 °С.
CаО + 3С → CаС2 + CO. (to = 2500-3000 оС).
- Далее карбид кальция обрабатывают водой по известной реакции.
- CаС2 + H2О → Cа(ОH)2 + C2H2.
- В итоге получается ацетилен высокой чистоты – 99,9 %.
- 5. высокотемпературным крекингом метана:
Высокотемпературный крекинг метана осуществляется по известной реакции дегидирования метана в электродуговых печах при температуре 2000-3000 °С и напряжении между электродами 1000 В. Выход ацетилена составляет 50 %.
- 6. различными способами пиролиза метана:
Разновидностью высокотемпературного крекинга метана являются регенеративный пиролиз (Вульф-процесс), окислительный пиролиз (Заксе-процесс или BASF-процесс), гомогенный пиролиз, пиролиз в среде низкотемпературной плазмы.
Так, в ходе регенеративного пиролиза сначала сжигают метан и разогревают насадку печи до 1350-1400 °С. Затем через разогретую насадку на доли секунды пропускают метан, в результате образуется ацетилен.
В ходе окислительного пиролиза метан смешивают с кислородом и сжигают. Образующееся тепло служит для нагрева остатка метана до 1600 °С, который дегидрирует в ацетилен. Выход ацетилена составляет 30-32 %.
В ходе гомогенного пиролиза метан и кислород сжигают в печи при температуре 2000 °С. Затем предварительно нагретый до 600 °С остаток метана пропускают через печь, в результате образуется ацетилен.
При пиролизе в среде низкотемпературной плазмы метан нагревают струей ионизированного газа (аргона или водорода).
Применение и использование ацетилена:
- – как сырье в химической промышленности для производства уксусной кислоты, этилового спирта, растворителей, пластических масс, синтетических каучуков, ароматических углеводородов,
- – для газовой сварки и резки металлов,
- – для получения технического углерода,
- – как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды.
Взрывоопасность ацетилена и безопасность при обращении с ним:
- Ацетилен обладает взрывоопасными свойствами.
- Поэтому обращение с ацетиленом требует строгого соблюдения правил техники безопасности.
- Ацетилен горит и взрывается даже в отсутствии кислорода и других окислителей.
- Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций.
- Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки.
Взрываемость ацетилена зависит от множества факторов: давления, температуры, чистоты ацетилена, содержания в нем влаги, наличия катализаторов и пр. веществ и ряда других причин.
Температура самовоспламенения ацетилена при нормальном – атмосферном давлении колеблется в пределах 500-600 °C.
При повышении давления существенно уменьшается температура самовоспламенения ацетилена. Так, при давлении 2 кгс/см2 (0,2 МПа, 1,935682 атм.) температура самовоспламенения ацетилена равна 630 °C.
А при давлении 22 кгс/см2 (2,2 МПа, 21,292502 атм.) температура самовоспламенения ацетилена равна 350 °С.
Присутствие в ацетилене частиц различных веществ увеличивают поверхность его контакта и тем самым снижает температуру самовоспламенения при атмосферном давлении.
Например, активированный уголь снижает температуру самовоспламенения ацетилена до 400 °С, гидрат оксида железа (ржавчина) – до 280-300 °С, железная стружка – до 520 °С, латунная стружка – до 500-520 °С, карбид кальция – до 500 °С, оксид алюминия – до 490 °С, медная стружка – 460 °С, оксид железа – 280 °С, оксид меди – до 250 °С.
Взрывоопасность ацетилена уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При определенных условиях ацетилен реагирует с медью, серебром и ртутью образуя взрывоопасные соединения. Поэтому при изготовлении ацетиленового оборудования (например, вентилей баллонов) запрещается применять сплавы, содержащие более 70 % Cu.
Для хранения и перевозки ацетилена используются специальные стальные баллоны белого цвета (с красной надписью «А»), заполненные инертным пористым материалом (например, древесным углём). При этом ацетилен хранится и перевозится в указанных баллонах в виде раствора ацетилена в ацетоне под давлением 1,5-2,5 МПа.
Примечание: © Фото //www.pexels.com, //pixabay.com
карта сайта
как получить ацетилен реакция ацетилен этен 1 2 вещество кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение ацетилена
напишите уравнение реакций ацетилен
Ацетилен: свойства и все характеристики
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?! Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Мало растворим в воде и очень хорошо в ацетоне. В виде ацетонового раствора его хранят в стальных баллонах, заполненных каким-нибудь инертным пористым материалом. Смеси ацетилена с воздухом взрывоопасны.
Рис. 1. Строение молекулы ацетилена.
Таблица 1. Физические свойства ацетилена.
| Молекулярная формула | СH≡CH (C2H2) |
| Молярная масса, г/моль | 26 |
| Плотность, г/л | 1,0896 |
| Температура плавления, oС | -80,8 |
| Температура кипения, oС | -83,6 |
Получение ацетилена
- Выделяют промышленные и лабораторные способы получения ацетилена. Так, в промышленности ацетилен получают путем высокотемпературного крекинга метана:
- 2CH4→ СH≡CH +3H2.
- В лаборатории ацетилен получают гидролизом карбида кальция:
- CaC2 +2H2O = Ca(OH)2 + C2H2.
- Кроме вышеперечисленных реакций, для получения ацетилена используют реакции дегидрирования алканов и алкенов:
- CH3-CH3→ СH≡CH +2H2;
- CH2=CH2→ СH≡CH +H2.
Химические свойства ацетилена
- Ацетилен вступает в реакции присоединения, протекающие по нуклеофильному механизму, такие как:
- — гидрирование
- СH≡CH +H2O→ [CH2=CH-OH] → CH3-CH=O (H2SO4 (18%), t = 90oC);
- — галогенирование
- СH≡CH +Br2→CHBr=CHBr + Br2 →CHBr2-CHBr2;
- — гидрогалогенирование
- СH≡CH +HСl→ CH2=CHCl + HCl → CH3-CHCl2.
- Кроме этого ацетилен способен образовывать соли при взаимодействии с активными металлами (1) и оксидом серебра (2):
- 2СH≡CH +2Na→2 СH≡C-Na + H2 (1);
- СH≡CH + Ag2O→ Ag- С≡C-Ag↓ + H2O (2).
- Он способен тримеризоваться:
- 3C2H2→ C6H6 (t = 600oC, kat = Cactive).
Применение ацетилена
Ацетилен является исходным продуктом для многих важнейших химических производств. Например, из ацетилена получают различные галогенпроизводные, такие как тетрахлорэтан и трихлорэтилен, являющиеся хорошими растворителями, а также винилхлорид, служащий мономером для получения поливинилхлорида. Кроме этого ацетилен используется для получения синтетических каучуков.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |